| |||
| |||
Επίπεδα ασκορβικού οξέως στο πλάσμα ασθενών με νόσο του
Ρarkinson
και αγγειακό Παρκινσονισμό
Γ.Π. ΠΑΡΑΣΚΕΥΑΣ, Ε. ΚΑΠΑΚΗ, Ο ΠΕΤΡΟΠΟΥΛΟΥ, Χ. ΖΟΥΡΝΑΣ
Νευρολογική Κλινική Πανεπιστημίου Αθηνών, Αιγινήτειο Νοσοκομείο
Περίληψη
Η συμμετοχή της οξειδωτικής καταπόνησης θεωρείται ουσιώδης, τόσο στην παθοφυσιολογία
της νόσου του Parkinson, όσο και της αθηροσκλήρωσης. Το ασκορβικό οξύ είναι
μια σημαντική αντιοξειδωτική ουσία του κυτταροπλάσματος και του εξωκυτταρίου
χώρου και ασκεί τη δράση της μέσω πολλών μηχανισμών νευροπροστασίας. Με υψηλής
απόδοσης υγρή χρωματογραφία προσδιορίστηκαν τα επίπεδα της ασκορβικού οξέως
στο πλάσμα ασθενών με νόσο του Parkinson και αγγειακό Παρκινσονισμό. Στη νόσο
του Parkinson δεν παρατηρήθηκε σημαντική διαφορά από την ομάδα ελέγχου, όμως
στον αγγειακό Παρκινσονισμό παρατηρήθηκε σημαντική μείωση της συγκέντρωσης ασκορβικού
οξέως στο πλάσμα. Το εύρημα αυτό επιβεβαιώνει την εμπλοκή των αντιοξειδωτικών
παραγόντων στους μηχανισμούς της αρτηριοσκλήρυνσης.
Λέξεις κλειδιά: Ασκορβικό οξύ, βιταμίνη C, οξειδωτική καταπόνηση νόσος Parkinson, αγγειακός Παρκινσονισμός.
Εισαγωγή
Υπάρχουν αρκετές ενδείξεις ότι η οξειδωτική καταπόνηση αποτελεί τουλάχιστον τον τελικό μηχανισμό καταστροφής των μονοαμινεργικών κυττάρων στη νόσο του Parkinson (ΝΠ).1,2 Έχει βρεθεί μείωση του μιτοχονδριακού συμπλέγματος Ι και της γλουταθειόνης, αυξημένη λιπιδική υπεροξείδωση, αυξημένη εναπόθεση σιδήρου στη μέλαινα ουσία και μείωση του ασκορβικού οξέως (ΑΟ) στον αμυγδαλοειδή πυρήνα.3,4,5 Η οξειδωτική καταπόνηση και η έλλειψη αντιοξειδωτικών ουσιών όπως το ΑΟ φαίνεται ότι εμπλέκεται επίσης στην παθοφυσιολογία της αθηρωματικής νόσου6,7,8 και, μαζί με την τοξικότητα εξ υπερδιεγέρσεως των NMDA υποδοχέων, στην εγκεφαλική ισχαιμία.9,10
Το ΑΟ είναι σημαντική αντιοξειδωτική βιταμίνη του κυτταροπλάσματος και του εξωκυττάριου χώρου.11 Δρά άμεσα εξουδετερώνοντας τις ελεύθερες ρίζες και έμμεσα αναγεννώντας τη βιταμίνη Ε (την κύρια αντιοξειδωτική ουσία των μεμβρανών) στη δραστική της μορφή, προστατεύοντας έτσι από την Λιπιδική υπεροξείδωση.11,12 Προστατεύει επίσης τους νευρώνες από την κυτταροτοξικότητα εξ υπερδιεγέρσεως των NMDA υποδοχέων13 και εμποδίζει την συσσώρευση βαρέων μετάλλων στον εγκέφαλο.14 Τέλος, αποτελεί συμπαράγοντα του ενζύμου ντοπαμίνη-β-υδροξυλάση και παίζει σημαντικό ρόλο στη βιοσύνθεση και αποθήκευση των κατεχολαμινών.11 Για την προστατευτική δράση του ΑΟ απαιτούνται φυσιολογικές ή αυξημένες συγκεντρώσεις. Αντίθετα, σε χαμηλές συγκεντρώσεις ή/και παρουσία μεταβατικών μετάλλων, όπως ο σίδηρος, το ΑΟ αποκτά οξειδωτικές ιδιότητες και προάγει την λιπιδική υπεροξείδωση, την αυτοοξείδωση των κατεχολαμινών και την τοξικότητα εξ υπερδιεγέρσεως των NMDA υποδοχέων.11,15.
Για τους παραπάνω λόγους προσδιορίσαμε τα επίπεδα ΑΟ στο πλάσμα ασθενών με ΝΠ και αγγειακό παρκινσονισμό (ΑΠ).
Ασθενείς και μέθοδοι
Ασθενείς: Από τη μεσοβασιλική φλέβα και ύστερα από 12ωρη νηστεία ελήφθη αίμα μεταξύ 9 και 10 π.μ. από από (α) 36 ασθενείς με κλινικώς βέβαιη ΝΠ διαγνωσμένη σύμφωνα με τα κριτήρια των Larsen και συν.,16 (β) 11 ασθενείς με ΑΠ, και (γ) 37 υγιείς εθελοντές που αποτέλεσαν την ομάδα ελέγχου (ΟΕ). Οι πάσχοντες από ΑΠ χαρακτηρίζονται κυρίως από υπερτονία-βραδυκινησία και ελάχιστο έως καθόλου ηρεμίας, ταυτόχρονη ύπαρξη πυραμιδικής ή/και ψευδοπρομηκικής σημειολογίας, μικρή έως ανύπαρκτη ανταπόκριση στην L-Dopa, και τουλάχιστον ένα παράγοντα αγγειακού κινδύνου (οι 10 είχαν υπέρταση, 6 είχαν υπερλιπιδαιμία, 5 στεφανιαία νόσο, και 4 σακχαρώδη διαβήτη τύπου ΙΙ). Στην αξονική ή/και μαγνητική τομογραφία ένας ασθενής παρουσίαζε πολλαπλά αγγειακά εγκεφαλικά επεισόδια, 9 παρουσίαζαν εικόνα μικροαγγειοπάθειας με πολλαπλά κενοτοπιώδη έμφρακτα, ενώ 1 ασθενής είχε διάχυτη «λευκοαραίωση» του τύπου Binswanger.
Μέθοδοι: Το αίμα τοποθετείτο σε ηπαρηνισμένα σωληνάρια και φυγοκεντρείτο στις 3000 rpm για 15 min στους 4 °C. Το λαμβανόμενο πλάσμα αποπρωτεϊνίζετο με τη μέθοδο της υπερδιήθησης, δηλ. με φυγοκέντρηση στις 12000 rpm για 15 min μέσα από φίλτρα Ultrafree-MC 5.000 NMWL (Millipore) αποτελούμενα από ανασυσταθείσα κυτταρίνη χαμηλής δεσμευτικής ικανότητος. Το αποπρωτεϊνισμένο πλάσμα φυλάσσετο στους -80 °C μέχρι να χρησιμοποιηθεί για τον προσδιορισμό του ΑΟ, εντός 6 μηνών από της αποθηκεύσεως. Η μέτρηση των επιπέδων ΑΟ πραγματοποιήθηκε με υγρή χρωματογραφία υψηλής απόδοσης.17,18 Η μέθοδος είναι ισοκρατική (ροή 1 ml/min), η κινητή φάση αποτελείται από διάλυμα 0,015 Μ ορθοφωσφορικού οξέως,5 η C18 στήλη είναι Delta-Pack 5 μ 100 Å (3,9x150 mm, Waters). Η ανίχνευση γίνεται σε μήκος κύματος 254 nm με ανιχνευτή υπεριώδους/ορατού (Waters 486) και o χρόνος έκλουσης του ΑΟ είναι 2,25 min. Η μέθοδος είναι γραμμική τουλάχιστον μέχρι τα 250 pg/ml και η μεταβλητότης μίας και πολλαπλών μετρήσεων είναι της τάξεως του 5% ή μικρότερη.19
Στατιστική ανάλυση: Οι τιμές ΑΟ στις διάφορες ομάδες ακολουθούσαν την κανονική κατανομή και δεν διέφεραν σημαντικά ως προς τις μεταβλητότητες. Έτσι για τις συγκρίσεις χρησιμοποιήθηκε η ανάλυση μεταβλητότητος μιας διευθύνσεως (1-ωαγ ANOVA), ακολουθούμενη από την "post-hoc" δοκιμασία του Newman-Keuls για το πολλαπλό των συγκρίσεων. Η τιμή α τέθηκε στο επίπεδο του 0,05.
Αποτελέσματα
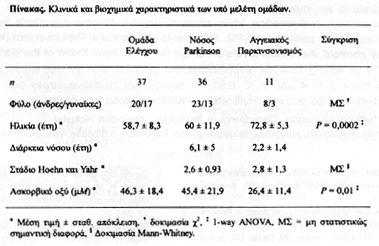
Τα κλινικά και βιοχημικά χαρακτηριστικά των υπό μελέτη ομάδων συνοψίζονται στον Πίνακα. Οι ομάδες δεν διέφεραν ως προς το φύλο, όμως οι ασθενείς με ΑΠ είχαν μεγαλύτερη ηλικία σε σχέση με τη ΝΠ και την ΟΕ (P<0,001 για αμφότερες τις συγκρίσεις).
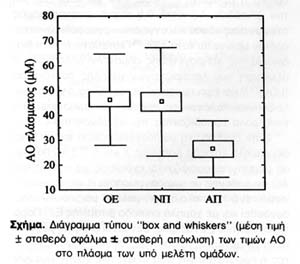
Παρατηρήθηκε στατιστικώς σημαντική μείωση των επιπέδων ΑΟ στους ασθενείς με ΑΠ σε σχέση με την ΘΕ (Ρ<0,01) και την ΝΠ (Ρ<0,01), ενώ οι ασθενείς με ΝΠ δεν διέφεραν από την ΘΕ (Εικόνα). Η ηλικία, το φύλο, και η διάρκεια νόσου δεν βρέθηκε να επηρεάζουν τα επίπεδα ΑΟ σε καμμία από τις ομάδες. Επίσης τα αποτελέσματα ήταν ανεξάρτητα της χορήγησης L-Dopa και δεν συσχετίζονταν με τη δοσολογία αυτής.
Συζήτηση
Αν και παλαιότερα είχε υποτεθεί ότι οι ασθενείς με ΝΠ μπορεί να παρουσιάζουν μειωμένα επίπεδα ΑΟ στο αίμα,20,21 οι περισσότερες από τις σύγχρονες μελέτες βρίσκουν φυσιολογικές συγκεντρώσεις στο αίμα και φυσιολογική διαιτητική πρόληψη.22-25 Τα αποτελέσματα της παρούσης μελέτης συμφωνούν με την άποψη αυτή.
Το ενδιαφέρον εύρημα της παρούσης μελέτης ήταν τα χαμηλά επίπεδα ΑΟ στον ΑΠ. Μειωμένα επίπεδα ΑΟ έχουν κατ' επανάληψη βρεθεί σε ασθενείς με αθηρωματική καρδιαγγειακή νόσο,8,26,27 παράγοντες κινδύνου όπως το κάπνισμα28 και η υπέρταση29,30 και σε οξέα αγγειακά εγκεφαλικά επεισόδια,31 έχει δε προταθεί ότι η μειωμένη διαιτητική πρόσληψη αυτού προδιαθέτει σε ανάπτυξη αρτηριοσκλήρυνσης.8,26,27,32 Υπολογίζεται ότι οι ασθενείς με φυσιολογικά επίπεδα ΑΟ έχουν 26% μικρότερο επιπολασμό αγγειακών εγκεφαλικών επεισοδίων απ' ότι αυτοί με οριακά ή μειωμένα επίπεδα, ενώ για κάθε αύξηση των επιπέδων ΑΟ κατά 0,5 mg/dl, ο επιπολασμός στεφανιαίας νόσου και αγγειακών εγκεφαλικών επεισοδίων μειώνεται κατά 11 %.26 Πιστεύεται ότι στη διαδικασία της αθηρογένεσης σημαντικό ρόλο παίζει η οξείδωση των λιποπρωτεϊνών χαμηλής πυκνότητας (LDL)33,34 και έχει προταθεί ότι το ΑΟ και άλλοι αντιοξειδωτικοί παράγοντες ασκούν τον προστατευτικό τους ρόλο εμποδίζοντας την οξείδωση αυτή.35
Στην εγκεφαλική μικροαγγειοπάθεια έχουν βρεθεί χαμηλά επίπεδα βιταμίνης Ε και Α.36 Στην παρούσα μελέτη παρουσιάζονται ενδείξεις για μείωση του ΑΟ σε ασθενής με μικροαγγειοπάθεια και παρκινσονισμό, ενώ σε παλαιότερη μελέτη μας, ο ΑΠ είχε συνδεθεί και με χαμηλά επίπεδα βιταμίνης Ε.37 Παρά τις θεωρητικές ενδείξεις, δεν είναι ακριβώς βεβαιωμένη με μεγάλες, προοπτικές, διπλές-τυφλές μελέτες η προστατευτική αξία εξωγενώς χορηγούμενων αντιοξειδωτικών βιταμινών. Αυτή τη στιγμή οι ασθενείς με αγγειακή εγκεφαλική νόσο, αλλά και ολόκληρος ο πληθυσμός, θα πρέπει να ενθαρρύνονται ώστε παράλληλα με τη μείωση των ζωικών λιπών να λαμβάνουν τροφές πλούσιες σε αντιοξειδωτικές ουσίες. Ωστόσο ο ακριβής τρόπος εξωγενούς φαρμακολογικής χορήγησης (περιεχόμένο σκευασμάτων, δόση κ.λ.π.), οι ενδείξεις και τα πιθανά ωφέλη παραμένουν αντικείμενο προς διερεύνηση.
ΒΙΒΛΙΟΓΡΑΦΙΑ
Fahn S, Cohen G. The oxidative stress hypothesis in Parkinson's s disease. Evidence supporting it. Ann Neurol 1992;23: 804-812.